Bisher produzierte China vor allem Generika. Nun etabliert sich das Land als Entwicklungs- und Zulassungsort für neue Wirkstoffe.
Martina Frei für die Online-Zeitung INFOsperber
«Die Chinesen werden uns überholen», prophezeite ein bekannter Schweizer Medizinprofessor vor bald 20 Jahren. Was die Medikamentenentwicklung betrifft, ist es nun soweit. Noch sind zwar die USA das Land, in dem die meisten neuen Medikamente weltweit zuerst zugelassen werden: 41 neu entwickelte Arzneimittel wurden 2024 laut einem Artikel in «Nature Reviews Drug Discovery» als Erstes dort registriert.
China aber holt stark auf. Laut «Nature Reviews Drug Discovery» wurden letztes Jahr bereits 39 aller weltweit zugelassenen Arzneimittel mit neuen Wirkstoffen zuerst in diesem asiatischen Land zugelassen. China hat damit sowohl Japan als auch Europa überholt.
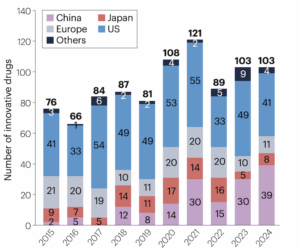
39 aller weltweit erstmals zugelassenen Medikamente mit neuen Wirkstoffen wurden 2024 in China registriert. Europa und Japan als Erstzulassungsorte verloren an Bedeutung. © S. Liu et al., «Nature Reviews Drug Discovery» 2025
Patentrecht revidiert, Begutachtungsfristen verkürzt
Mit einer Reihe von regulatorischen Maßnahmen habe der chinesische Staat im letzten Jahrzehnt den Boden für diese Entwicklung bereitet. Zudem pumpten die Investoren mehr Geld in die chinesische Pharmaforschung. Das schlage sich in der Anzahl neu zugelassener Medikamente nieder.
Dass China «vom Generika-Produzenten zum aufstrebenden Zentrum pharmazeutischer Innovation» wurde, wie die chinesischen Autoren in «Nature Reviews Drug Discovery» schreiben, liege unter anderem daran, dass das asiatische Land das Patentrecht revidierte und beschloss, gewisse Begutachtungsfristen zu verkürzen. Für Pharmafirmen zählt jeder Tag, an dem ein Medikament früher auf den Markt kommt, weil es so schneller und länger Gewinn abwirft, bis das Patent abläuft.
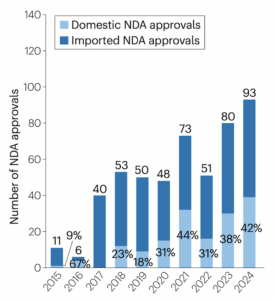
In China werden immer mehr Medikamente mit neuen Wirkstoffen zugelassen. Der Anteil dieser Arzneimittel, die auch dort entwickelt wurden, nimmt zu (hellblaue Balken). © S. Liu et al., «Nature Reviews Drug Discovery» 2025
Arzneimittelbehörden im Wettstreit
Zwischen 2015 und 2024 wurden laut «Nature Reviews Drug Discovery» 918 neue Medikamente erstmals irgendwo auf der Welt zugelassen, im Durchschnitt also etwa 100 pro Jahr.
«Je attraktiver der Markt, desto früher kommt ein Gesuch», erläutert ein Artikel auf der Webseite von Swissmedic. «Pharmafirmen geben die Gesuche für die Marktzulassung neuer Medikamente je nach Land und Region zu einem anderen Zeitpunkt bei der jeweiligen Behörde ein. Sie bevorzugen dabei einzelne Märkte und konzentrieren sich zunächst auf jene Regionen, in denen sie möglichst viele Patientinnen und Patienten erreichen.» Die Schweiz als kleiner Markt hat dabei regelhaft das Nachsehen. Sie erhält Zulassungsgesuche im Mittel 417 Tage später als beispielsweise die US-Behörde FDA.
China war – bisher – ebenfalls ein Nachzügler: Die Hersteller reichten ihre Zulassungsgesuche für neue Wirkstoffe dort im Mittel erst 822 Tage später ein als bei der FDA. Das ergab eine Stichprobe mit 25 neuen Medikamenten durch das «Centre for Innovation in Regulatory Science» (Cirs).
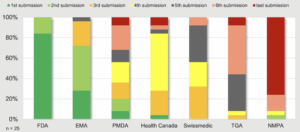
Diese Analyse einer Stichprobe von 25 Medikamenten zeigt, wo die Hersteller ihren ersten Zulassungsantrag weltweit einreichten (grün), wo den zweiten (hellgrün), den dritten (orange), den vierten (gelb), den fünften (grau), den sechsten (rosa) und den letzten (rot; FDA=US-Zulassungsbehörde, EMA=europäische Z., PMDA=japanische Z., TGA=australische Z., NMPA=chinesische Z.). © Cirs, R&D Briefing 102
Das Cirs und die Pharmahersteller vergleichen alljährlich, welche Landesbehörde neue Wirkstoffe am schnellsten zulässt und wo ihnen am häufigsten Erleichterungen gewährt werden. Mit im Mittel 290 Tagen Begutachtungszeit war die japanische Behörde letztes Jahr die schnellste. Swissmedic bildete laut dem «Cirs» mit 444 Tagen das Schlusslicht beim Vergleich von sechs westlichen Zulassungsbehörden.
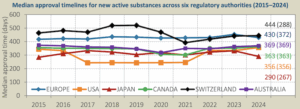
Mittlere Dauer des Zulassungsverfahrens bei Medikamenten mit neuen Wirkstoffen: Die japanische (rot) und die US-Behörde (orange) waren 2024 erneut am schnellsten, Swissmedic (schwarz) und die EU-Behörde (blau) brauchten am längsten. © 2025 CIRS, R&D Briefing 101
China fehlt in dieser Auswertung. Bei der Stichprobe der 25 Medikamente, die das «Centre for Innovation in Regulatory Science» analysierte, benötigte die chinesische Zulassungsbehörde etwa ebenso lang wie Swissmedic.
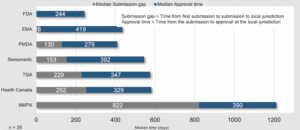
Analyse von 25 neu zugelassenen Wirkstoffen: Bei der chinesischen Behörde NMPA reichten die Hersteller erst mit 822 Tagen Verzögerung den Zulassungsantrag ein (grauer Balken), verglichen mit dem Antrag bei der US-Behörde FDA. Die Begutachtung (blau) des Zulassungsgesuchs dauerte in China etwa gleich lang wie bei Swissmedic. © Cirs, R&D Briefing 102
Investoren setzen auf teure Krebsmedikamente
Die meisten der in China entwickelten neuen Wirkstoffe sind Krebsmedikamente. Bei den Investoren hoch im Kurs sind laut dem Artikel Zelltherapien, sogenannte «small molecules» sowie therapeutische Vakzinen zum Beispiel gegen Krebs.
2019 erhielt das erste, in China entwickelte Krebsmedikament die Zulassung in den USA, danach in den Vereinten Arabischen Emiraten, gefolgt von Europa und Japan. Vergangenes Jahr bekamen bereits 14 in China entwickelte Substanzen in anderen Ländern die Zulassung. Darunter waren die Schweiz (2 neue Substanzen), die EU (4), Australien (1), Russland (1), Japan (4), Burma(1), die USA (2) und Indonesien (1).











